乳腺癌是全球女性中最常见的恶性肿瘤,其中雌激素受体α(ERα)阳性患者约占70%以上。尽管内分泌治疗在早期患者中取得显著疗效,但耐药性问题仍是临床治疗的主要挑战。近年来研究发现,除ESR1突变外,雄激素受体信号通路的异常活化也成为导致乳腺癌内分泌耐药的重要机制之一。
近日,武汉大学药学院周海兵教授团队在药物化学领域顶尖期刊《Journal of Medicinal Chemistry》上发表题为“Kill Two Birds with One Stone: An Efficient and Potent AR CBS-Targeted Degrader Reverses Breast Cancer Resistance via Concurrent AR Degradation and ERα Transcriptional Suppression”的研究论文。该研究设计并合成了一系列靶向AR共激活因子结合位点的PROTAC降解剂,其中化合物18o展现出显著的抗肿瘤活性与良好的安全性,为逆转乳腺癌内分泌耐药提供了全新思路。
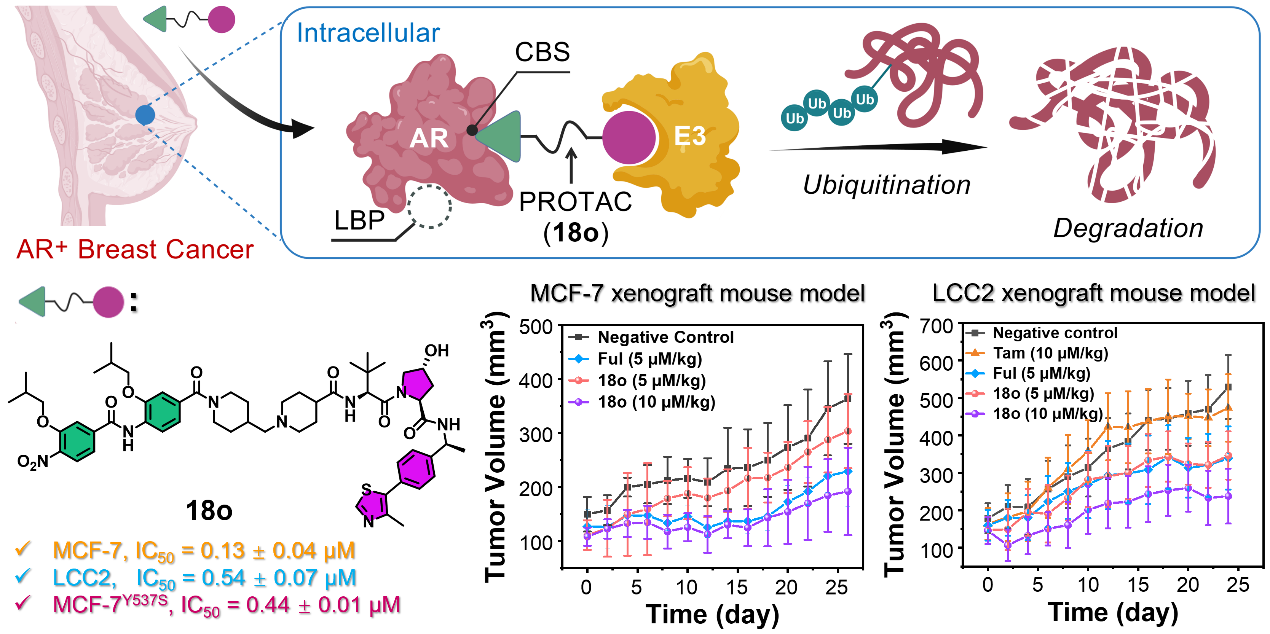
AR在80–90%的ERα+乳腺癌中过表达,并通过与ERα的信号串扰促进肿瘤增殖与耐药。传统AR拮抗剂如恩杂鲁胺等虽在临床中显示出一定乳腺癌治疗效果,但其作用机制依赖于AR配体结合域(LBD),易因该区域突变而导致药物失效。为解决这一难题,研究团队创新性地将研究靶点转向AR的共激活因子结合位点(CBS),设计靶向AR-CBS的蛋白水解靶向嵌合体(PROTAC)分子,旨在从结构上规避传统药物结合模式带来的潜在耐药风险。
基于此,团队以AR-CBS抑制剂D2为弹头,通过PROTAC设计策略,构建并发现首个靶向AR-CBS的PROTAC降解剂18o。该降解剂在MCF-7乳腺癌细胞中展现出高效的AR降解活性,并对野生型、ESR1突变型及他莫昔芬耐药型乳腺癌细胞均表现出亚微摩尔级别的抑制活性;尤其具有下调ERα蛋白水平并同时显著抑制其转录活性的特点;最后,在MCF-7与LCC2移植瘤模型中,18o表现出显著的抑瘤效果,且未引起明显毒性反应。
该研究首次将PROTAC技术成功应用于AR-CBS这一难成药靶点,开发的降解剂18o实现了“一石二鸟”的双重治疗效果:在高效降解AR的同时,间接抑制ERα信号通路,为AR阳性乳腺癌的治疗提供了有效先导化合物与创新策略。
该研究工作由武汉大学药学院博士吴亦何、谢宝花与梁锦森为共同第一作者完成,周海兵教授、董春娥教授与浙江大学韩欣教授为共同通讯作者。
以上研究工作得到了国家自然科学基金、国家重点研发计划项目和教育部免疫与代谢前沿科学中心的支持。
论文链接:https://doi.org/10.1021/acs.jmedchem.5c01926