近日,武汉大学药学院田间团队联合韩国高丽大学Jong Seung Kim团队,在国际权威期刊《Angewandte Chemie International Edition》发表题为“MitoSiege-Driven Catalase Collapse: A GSH-Responsive, Mitochondria-Targeted COF Prodrug for Amplified Chemodynamic Therapy”的研究论文。该研究成功开发出一种靶向线粒体的共价有机框架(COF)纳米前药COF-31@P,显著提升了化学动力学治疗(CDT)的精准性与疗效。该研究为解决CDT中活性氧物种靶向递送和可控生成的难题提供了新思路。
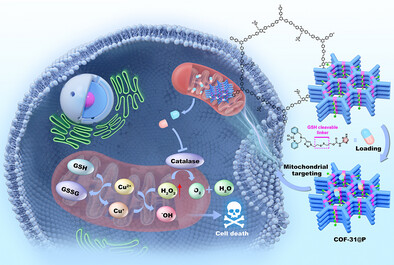
化学动力学治疗作为一种新兴的肿瘤治疗策略,依托芬顿或类芬顿反应将肿瘤细胞内过氧化氢(H₂O₂)转化为高毒性的羟基自由基(·OH),从而诱导肿瘤细胞凋亡。由于其依赖肿瘤微环境特性,CDT具有高特异性和低系统毒性的优势,然而,如何实现·OH的高效、定向生成并精准作用于关键细胞器仍是当前研究的瓶颈。
针对这一挑战,合作研究团队设计并构建了COF-31@P这一多功能纳米前药系统。该系统以结构规整、孔道可调的共价有机框架为载体,通过二硫键连接类芬顿金属铜配合物和过氧化氢酶抑制剂3-氨基-1,2,4-三唑(3-AT)。在肿瘤细胞特有的高浓度谷胱甘肽(GSH)环境中,二硫键发生断裂,精准释放活性组分。释放的铜配合物通过类芬顿反应高效催化H₂O₂生成·OH,而3-AT则通过抑制过氧化氢酶活性阻止H₂O₂被分解,进一步增加了细胞内H₂O₂的积累,从而显著增强了·OH的生成效率。此外,该纳米系统表现出优异的线粒体靶向能力,可定向富集于肿瘤细胞的能量工厂—线粒体,引发氧化应激和细胞凋亡,实现对肿瘤细胞的高效杀伤。在体内外实验中,COF-31@P均表现出卓越的抗肿瘤效果和良好的生物相容性,未对正常组织造成明显损伤,表明其具备较高的治疗安全性。
该研究通过巧妙的纳米设计整合了细胞器靶向、GSH响应释放和多机制协同增效策略,不仅推动了CDT领域的理论创新,也为临床转化提供了具有广阔前景的候选方案。COF-31@P的成功开发有助于推动共价有机框架载体在精准纳米医学中的应用。
武汉大学药学院2021届硕士生(现高丽大学博士生)丁启航和2025届硕士生王波为论文(共同)第一作者,田间教授和韩国高丽大学Jong Seung Kim教授为论文共同通讯作者,武汉大学药学院为论文第一完成单位。该工作获得了国家自然科学基金、韩国国立研究基金和国家留学基金委的支持。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202509183