近日,武汉大学田间团队在国际权威期刊《Advanced Science》 在线发表题为“Bacteria-Targeted Single-Atom Nanozyme With Photothermal-Augmented Multi-Enzymatic Cascade and NO Delivery for Enhanced Infected Wound Healing”的研究论文。该研究建立了一种时空控制的治疗范式,可同时解决慢性伤口的感染控制和组织再生问题,为治疗复杂的糖尿病伤口提供了有效的转化策略。
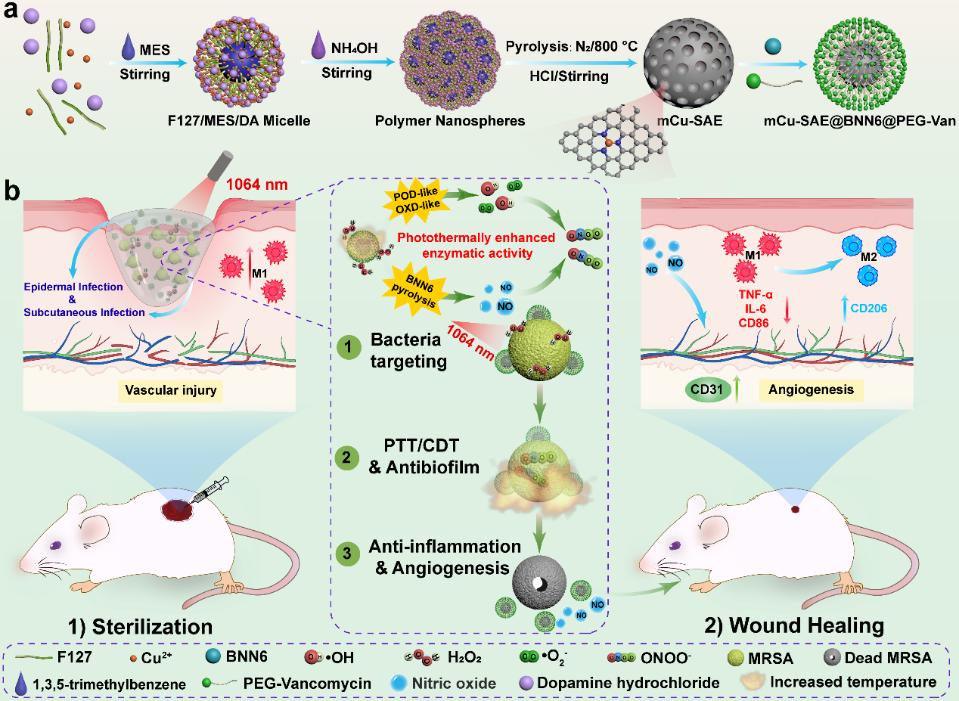
糖尿病作为一种常见的内分泌代谢疾病,其全球发病率正逐年攀升,并常伴随多种并发症,其中糖尿病足溃疡最为严重。田间教授团队研发了一种细菌靶向的纳米复合结构(简称CBPV,即mCu-SAE@BNN6@PEG-Van),该结构通过时空可控的方式产生活性物质,实现了一氧化氮(NO)、化学动力学(CDT)和光热(PTT)多模式协同治疗糖尿病伤口,从而显著降低了单一疗法可能带来的生物安全风险。
该团队设计的单原子铜纳米酶具有非常规的Cu-N₃配位结构,这一特殊几何构型使Cu-N₃中心与H₂O₂之间产生强相互作用,能够高效催化H₂O₂分解,而这一过程在经典的Cu-N₄结构中则难以实现。因此,CBPV表现出优异的类过氧化物酶(POD)和氧化酶(OXD)催化活性。其表面修饰的万古霉素配体实现了对细菌的精准靶向,相比非靶向性纳米颗粒,在感染部位富集和靶向细菌的能力显著增强。聚多巴胺衍生的碳载体赋予CBPV卓越的近红外二区(1064 nm)光热转换性能(η = 43.9%)。该性能不仅通过热增强效应放大了化学动力学治疗效果,还触发了所负载的温敏分子BNN6分解释放NO。NO的释放呈现出清晰的双相治疗机制:在初始杀菌阶段,NO与活性氧(•OH/•O₂⁻)反应生成具有强杀菌作用的过氧亚硝酸根(ONOO⁻),从而建立自增强氧化链;而在后续愈合阶段,持续释放的低浓度NO则促进成纤维细胞迁移与胶原蛋白成熟,加速组织修复。
研究结果进一步表明,NIR-II激光的深部组织穿透能力使CBPV能够有效治疗深部感染,在皮下模型中成功清除了耐甲氧西林金黄色葡萄球菌(MRSA)生物膜。该研究将反应活性物质的精准释放与细菌靶向技术相结合,在时空维度上实现协同调控,为抗菌治疗与组织再生提供了一种创新策略。
武汉大学药学院2023级硕士生陈君阳为论文第一作者,田间教授、武汉大学中南医院周建良教授和吉林大学杨英威教授为论文共同通讯作者,武汉大学药学院为论文第一完成单位,以上研究工作得到国家自然科学基金以及中南医院转化医学和交叉研究联合基金的支持。
文章链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202509621