近日,武汉大学药学院徐丹教授团队在环境科学与技术领域顶级期刊Environmental Science & Technology(ES&T)上以封面论文形式发表了题为“Disrupted Cholesterol Homeostasis as a Mechanism of Pharmaceutical-Induced Neurodevelopmental Toxicity: A Transgenic Zebrafish Screening Model for abcg1”的重要研究成果。该研究首次系统揭示了常见环境药物残留通过扰乱胆固醇稳态诱导神经发育毒性的共性机制,并成功构建了一种可用于实时可视化监测的转基因斑马鱼模型,为药物及环境污染物的神经发育毒性评估提供了新工具与新视角。


研究背景:环境药物污染与神经发育威胁
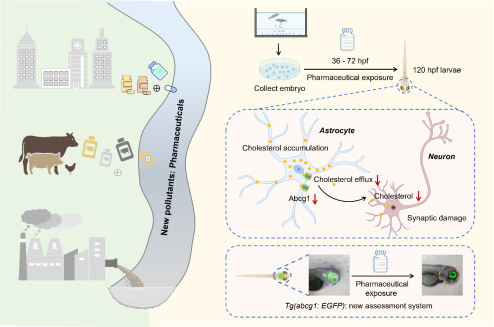
随着工业化进程加快和药品消费量增长,人用与兽用药物持续进入水环境,成为不可忽视的新污染物。合成糖皮质激素、非甾体抗炎药和抗生素等药物在全球水体中被广泛检出,例如地塞米松在华年使用量高达2200吨,乙酰氨基酚甚至在极地水域中也被检测到。孕期是胎儿中枢神经发育的关键窗口期,母体暴露于环境污染物显著增加子代神经发育障碍风险。然而,传统毒性评估方法效率低、机制不明确,亟需开发高效、灵敏的毒性筛查平台。
创新发现:胆固醇稳态紊乱是核心机制
本研究聚焦五种常见药物——泼尼松、地塞米松、乙酰氨基酚、阿莫西林和阿奇霉素,利用斑马鱼胚胎模型,发现在36–72 hpf(受精后小时)关键窗口期暴露于这些药物可引起孵化率下降、死亡率上升以及运动行为异常。更重要的是,研究团队从脂代谢角度入手,发现所有受试药物均引起神经元胆固醇水平显著降低,而星形胶质细胞中的胆固醇却异常积累。这一现象提示胆固醇从胶质细胞向神经元的转运过程受阻。通过筛选胆固醇合成与转运相关基因,研究发现胆固醇外排转运蛋白abcg1的表达在药物暴露后一致下调,而其他关键因子如hmgcr、abca1、apoe等未呈现明显变化。这一发现得到原位杂交与免疫荧光实验的证实。
机制验证:abcg1是关键靶点
为确认abcg1的功能,研究团队通过 Morpholino(MO)敲低和mRNA过表达实验证明:抑制abcg1表达可模拟药物暴露引起的胆固醇分布异常、突触相关基因(bdnf、snap25、shank3)下调及行为缺陷;而过表达abcg1则能显著缓解药物导致的神经毒性表现。
技术突破:构建转基因斑马鱼荧光报告模型
基于上述发现,团队成功构建了Tg(abcg1:EGFP)转基因斑马鱼品系,可实现abcg1表达的实时、可视化监测。该模型对已知神经发育毒物(如羟氯喹、二甲双胍)表现出高灵敏性和特异性反应,而对阴性对照化合物(维生素C、氯雷他定)无显著响应,具备良好的筛选可靠性。
研究意义与应用前景
本研究不仅揭示了环境药物诱导神经发育毒性的共性机制——即通过抑制abcg1扰乱胆固醇稳态,还提供了一套机制研究与毒性筛查相结合的系统解决方案。所构建的转基因斑马鱼模型为高通量、实时监测药物与环境污染物神经毒性提供了重要工具,可广泛应用于孕期药物安全评价、环境水质监测与生态风险评估、神经发育疾病的分子机制研究。该成果对公共健康政策制定(如孕期用药指南)以及神经毒理学的标准化、精准化发展具有重要意义。
该研究于2025年正式发表于Environmental Science & Technology,并当选为当期封面文章。武汉大学药学院徐丹教授为论文独立通讯作者,硕士研究生周昕丽、博士研究生骆名翠和代高乐为共同第一作者。研究得到了发育源性疾病湖北省重点实验室主任汪晖教授以及重点实验室PI张瑞霖教授的指导,并获得了张瑞霖教授提供的斑马鱼研究平台的支持。同时,感谢中国科学院水生生物研究所对本项目的支持,以及段明研究员在Noldus行为仪器使用和技术方面的帮助。研究受到国家重点研发计划(2020YFA0803900、2024YFA1802700)及国家自然科学基金(82474017)资助。
文章链接:https://doi.org/10.1021/acs.est.5c04496